02-февруари-2026
Уважаеми медицински специалисти,
Viatris Healthcare Limited, Ирландия и Майлан ЕООД, компания на Viatris, в качеството си на представител на Viatris Healthcare Limited в България, в съгласие с Европейската агенция по лекарствата (EMA) и Изпълнителна Агенция по Лекарствата (ИАЛ), Ви информират за следното:
Резюме
- Viatris е получил съобщения за кафяво оцветяване и запушване на иглата при предварително напълнени спринцовки Arixtra. Този дефект в качеството е свързан с наличието в иглата на окислена желязна частица с външен произход.
- Въпреки че дефектът се оценява като много рядък, той може да се появи случайно сред партидите, разпространявани понастоящем на пазара, и потенциално може да засяга всички видове опаковки на Arixtra.
- Следвайте следните предпазни мерки преди отпускане или прилагане на Arixtra:
- Внимателно инспектирайте всички предварително напълнени спринцовки Arixtra за необичайно оцветяване в основата на иглата;
- Ако основата на иглата на предварително напълнена спринцовка е необичайно оцветена (както е показано на Фигура 1), не отпускайте и не прилагайте Arixtra. Вместо това върнете опаковката на търговеца на едро и/или Viatris за замяна.
- Информирайте пациентите и болногледачи за този дефект в качеството и ги посъветвайте относно предпазните мерки при боравене, включително изискването за връщане на всички опаковки, в които се наблюдава този дефект в качеството.
Фигура 1: Пример за спринцовка с необичайно оцветяване в основата на иглата
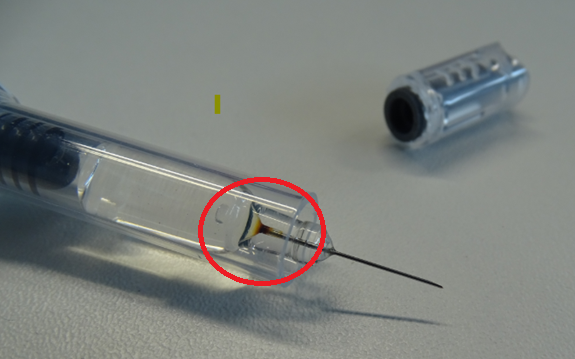
© 2025 Viatris
Контекст на опасенията за безопасност
Arixtra е показан за:
- Профилактика на венозна тромбоемболия (ВТЕ) при възрастни, подложени на големи ортопедични операции на долните крайници като фрактури на бедрената кост, тежки операции на коляното или операции за смяна на тазобедрената става. (*)
- Профилактика на венозна тромбоемболия (ВТЕ) при възрастни, подложени на коремна операция, при които е установен висок риск от развитие на тромбоемболични усложнения като пациенти с предстояща коремна операция по повод карцином. (*)
- Профилактика на венозна тромбоемболия (ВТЕ) при възрастни нехирургични пациенти с определен висок риск за развитие на венозна тромбоемболия, които са имобилизирани поради остро заболяване като сърдечна недостатъчност и/или остри респираторни заболявания, и/или остри инфекции или възпалително заболяване. (*)
- Лечение на нестабилна стенокардия или миокарден инфаркт без елевация на ST-сегмента (UA/NSTEMI) при възрастни, при които не е показано спешно (<120 мин) интензивно лечение (перкутанна коронарна интервенция). (**)
- Лечение на миокарден инфаркт с елевация на ST-сегмента (STEMI) при възрастни, които са лекувани с тромболитици или които първоначално не са получили друг вид реперфузионна терапия. (**)
- Лечение на възрастни с остра симптоматична спонтаннa повърхностна венoзна тромбоза на долните крайници, без съпътстваща дълбока венозна тромбоза. (*)
- Лечение на възрастни с остра дълбока венозна тромбоза и лечение на остър белодробен емболизъм, с изключение на хемодинамично нестабилни пациенти, при които е необходима тромболиза или белодробна емболектомия. (***)
Arixtra е разрешена за употреба в ЕС/ЕИП в следните концентрации:
- Arixtra 1.5 mg/0.3 ml инжекционен разтвор, предварително напълнена спринцовка;
- Arixtra 2.5 mg/0.5 ml инжекционен разтвор, предварително напълнена спринцовка;
- Arixtra 5 mg/0.4 ml инжекционен разтвор, предварително напълнена спринцовка;
- Arixtra 7.5 mg/0.6 ml инжекционен разтвор, предварително напълнена спринцовка;
- Arixtra 10 mg/0.8 ml инжекционен разтвор, предварително напълнена спринцовка.
До момента текущото разследване на производството показва, че всички партиди са произведени, опаковани и тествани съгласно разрешението за употреба и отговарят на регистрираните спецификации. Разследването е в ход с цел идентифициране на първопричината и прилагане на подходящи коригиращи/превантивни мерки.
Потенциалните рискове от използването на предварително напълнена спринцовка, която е необичайно оцветена, включват липса на ефикасност поради запушване на иглата, както и нежелани ефекти при прилагане на засегнати спринцовки. Тези събития могат да включват реакции на свръхчувствителност, усложнения на мястото на инжектиране (включително счупване на игла), тромбоемболични ефекти и системни инфекции.
Призив за съобщаване на нежелани лекарствени реакции
Бихме искали да напомним, че медицинските специалисти са задължени според Закона за лекарствените продукти в хуманната медицина (ЗЛПХМ) да съобщават незабавно на притежателя на разрешението за употреба или на Изпълнителна агенция по лекарствата (ИАЛ) за всяка подозирана сериозна нежелана лекарствена реакция и да предоставят при поискване допълнителна информация от проследяването на случая.
Данни за контакт с притежателя на разрешението за употреба (ПРУ)/Представителя на ПРУ в България
|
Притежател на разрешение за употреба Viatris Healthcare Limited |
Представител на ПРУ в България Майлан ЕООД |
Данни за контакт с Изпълнителна агенция по лекарствата:
Изпълнителна агенция по лекарствата (ИАЛ)
ул. Дамян Груев №8
1303, гр. София
Р. България
тел.: +359 2 8903 417
факс: +359 2 8903 434
e-mail: Този имейл адрес е защитен от спам ботове. Трябва да имате пусната JavaScript поддръжка, за да го видите.
Формуляр за съобщаване на нежелани лекарствени реакции от медицински специалисти
Съобщавайте нежеланите реакции на Изпълнителна агенция по лекарствата:
- тел.: +359 2 8903417
- e-mail: Този имейл адрес е защитен от спам ботове. Трябва да имате пусната JavaScript поддръжка, за да го видите.
Онлайн:
 Формуляр за съобщаване на нежелани лекарствени реакции от медицински специалисти
Формуляр за съобщаване на нежелани лекарствени реакции от медицински специалисти
Ако имате въпроси или се нуждаете от допълнителна информация, моля свържете се с представителя на ПРУ, посочен по горе.
BG-VIA-04 (01/2026)


